Reporte de Casos
Reoperación utilizando reconstrucción valvular aórtica como
cirugía de salvataje en paciente con carditis reumatoide extensa
Redo aortic valve reconstruction
as saving surgery in a patient with severe
rheumatoid cardiac disease
Pedro
Rojas1,a,
Josué
Sisniegas1,a,
Cristian
Aguilar2,c,
Necemio Aranda1,b,
Josías
Ríos1,b
https://orcid.org/0000-0002-4396-7954
DOI:
https://doi.org/10.47487/apcyccv.v2i2.128
Resumen
La combinación de regurgitación
valvular aórtica, aortitis y estenosis sub aórtica no es frecuente en pacientes
con artritis reumatoide. Además, el tratamiento quirúrgico de estas entidades puede
ser desafiante y con resultados inadecuados. En este trabajo reportamos el caso
de una paciente con regurgitación aórtica severa, raíz aórtica de inaccesible
abordaje secundaria a aortitis reumatoide, y estenosis sub aórtica tratada en
primera instancia con reemplazo valvular aórtico. Reoperamos
a la paciente debido a una falla protésica aguda y se efectuó una
reconstrucción valvular aórtica con pericardio bovino siguiendo la técnica de
Ozaki con buenos resultados
Palabras
clave:
Artritis Reumatoide; Reoperación; Válvula Aórtica
(fuente: DeCS BIREME).
Abstract
The combination of aortic regurgitation, rheumatoid aortitis, and subaortic
stenosis is rare in patients with rheumatoid arthritis. Moreover, the surgical treatment
of these entities can be challenging and with non-adequate results. We report
a case of a patient with severe aortic
regurgitation, inaccessible
aortic root secondary to rheumatoid
aortitis, and severe subaortic
stenosis initially treated by aortic
valve replacement. We reoperated the
patient due to acute prosthetic
valve failure by an aortic
valve reconstruction using bovine pericardium
and Ozaki technique with good outcomes.
Keywords: Arthritis Rheumatoid; Reoperation; Aortic Valve (source: MeSH NLM).
La artritis reumatoide (AR) es una
enfermedad inflamatoria crónica con
diversas manifestaciones cardiovasculares (1).
Un reporte de autopsias a pacientes
con AR evidenció alguna forma de enfermedad cardiovascular en 60% de los casos(2), lo cual demuestra una elevada tasa de prevalencia.
Rara vez un solo paciente desarrolla enfermedad severa que afecte la válvula
aórtica (VA), la raíz aórtica (RA) y el miocardio. Las técnicas quirúrgicas
clásicas de reemplazo de la VA y la RA pueden volverse ineficaces de acuerdo con
los cambios anatómicos secundarios a la AR y el grado de inflamación del tejido
(3). La sobrevida posreconstrucción de la VA usando
pericardio autólogo ha sido reportada en 85,9% a los 118 meses de seguimiento,
sin ningún reporte de fracaso en la reoperación
(4,5). Reportamos un caso de reoperación con
reconstrucción de la VA usando pericardio bovino en una paciente con falla
aguda de la prótesis valvular aórtica, aortitis, e infiltración miocárdica
secundaria a AR.
Reporte de caso
Una mujer de 40 años con AR fue
admitida por emergencia con disnea severa y dolor torácico. Era portadora de
marcapaso endocárdico bicameral y medicación inespecífica para AR. El examen físico
mostró un soplo sistólico-diastólico de moderada intensidad en
foco aórtico
y deformidad por desviación cubital en las manos. La
ecocardiografía transesofágica (ETE) reveló movimiento restrictivo de las
valvas derecha y no coronariana con regurgitación
severa, estenosis subaórtica severa, y signos de
enfermedad infiltrativa cardíaca (Fig. 1A). En la tomografía computarizada se observó
tejido periaórtico grueso (Fig. 1B), pero no se pudo
medir el anillo aórtico. La biopsia endomiocárdica
fue negativa para amiloidosis cardíaca con fibrosis intersticial focal.
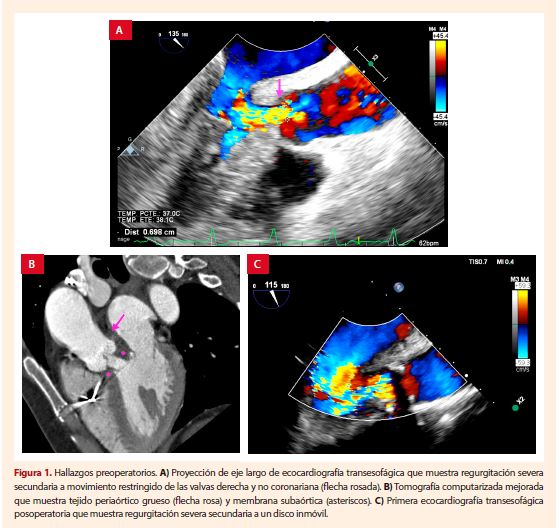
El Heart Team
decidió cirugía de reemplazo de la VA. En sala de operaciones se evidenció
inflamación periaórtica extensa y una raíz aórtica inadecuada.
Después de la resección de la membrana subaórtica y
de las valvas, se implantó con dificultad una prótesis mecánica número 21. La
cirugía de Bentall no se realizó debido a que la firme
adhesión de la aorta a las estructuras adyacentes podía causar lesiones secundarias.
La ETE intraoperatoria evidenció implantación oblicua de la prótesis aórtica con regurgitación moderada, no obstante, la cirugía culminó y
la paciente fue trasladada a cuidados intensivos. La ETE posoperatoria evidenció
regurgitación severa debido a la inmovilidad del disco posterior de la válvula (Fig.
1C), por lo que se decidió la reconstrucción de la VA como cirugía de salvataje.
La paciente fue operada 48 h después de
la primera intervención usando reesternotomía media; se
evidenció pericardio autólogo inadecuado para la reconstrucción, por lo que no se
usó. Se realizó canulación aórtica y bicava, y se inició
la circulación extracorpórea (CEC); se efectuó apertura alta de la aorta y se retiró
la prótesis aórtica. Se enviaron dos muestras para análisis (tejido aórtico y miocardio).
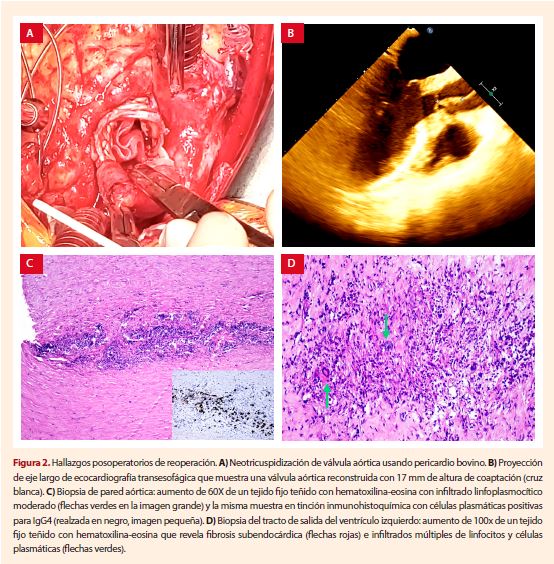
Se midió la distancia entre cada comisura, y se realizó la reconstrucción de la
VA usando pericardio bovino con la técnica de Ozaki (4) (Fig. 2A). Se recortaron
dos cúspides pericárdicas de 21-mm y una de 23-mm, que luego se suturaron al anillo.
Se realizó la salida de la CEC sin complicaciones. La ETE intraoperatoria
mostró la nueva válvula aórtica sin regurgitación y con apropiada altura de coaptación
(Fig. 2B).
El análisis histopatológico de las
muestras mostró degeneración mixoide de las valvas aórticas; infiltrado linfoplasmocitario moderado en la aorta, con células
plasmáticas positivas a inmunoglobulina G4 (IgG4) (Fig. 2C); fibrosis
subendocárdica con múltiples infiltrados de células linfoplasmocíticas
en todo el miocardio subaórtico (Fig. 2D).
La paciente fue tratada con altas
dosis de prednisona y dada de alta a sala general después de dos días en la unidad
de cuidados intensivos, sin complicaciones. En la ecocardiografía posquirúrgica
no se evidenció
regurgitación en la nueva VA. En el seguimiento a los tres meses, la paciente
presentó buena evolución, usando bajas dosis de corticosteroides y sin
anticoagulación.
Discusión
Las manifestaciones cardiovasculares
son una de las principales
causas de mortalidad
y morbilidad extraarticular en la AR (6). Cualquier parte
del corazón puede
ser afectada por la inflamación
autoinmunitaria; las características usuales incluyen pericarditis,
miocarditis, arteritis, endocarditis crónica y enfermedad valvular. La
incompetencia de la VA es infrecuente mientras que su prevalencia ha sido
reportada entre 9 y 33% (1). El mecanismo de la regurgitación reumática de la
VA es la dilatación del anillo, secundaria a la aortitis, destrucción
inflamatoria de las valvas o prolapso de una cúspide degenerada con inflamación
activa (3). Nuestra paciente presentó degeneración de las valvas de la VA, infiltración de la RA,
adhesiones inflamatorias, pero sin dilatación de la aorta ascendente.
En años recientes, la mortalidad
hospitalaria para casos de reemplazo electivo de la VA en AR es menor a 2%,
pero esos reportes no incluyen pacientes con aortitis concomitante, enfermedad
extensa, o reoperados (6). Levine et al. realizaron
reemplazo de válvula en cuatro pacientes con aortitis reumatoide y
regurgitación de la VA; intentaron evitar la anticoagulación en estos
pacientes, así dos recibieron válvulas biológicas, y dos recibieron homoinjertos. La mitad de los pacientes estuvieron bien a
los tres años de seguimiento, y los demás se perdieron (3).
Reportes adicionales de reemplazo de
la VA en las aortitis son secundarios a otras enfermedades inflamatorias. Xu (7) trató quince pacientes con enfermedad autoinmune de
la VA y aortitis mediante el procedimiento de reemplazo de válvula, reparación
y reemplazo de la RA. Finalmente, más del 50% de los pacientes recibieron el
procedimiento de Bentall como plan inicial o en reoperación para obtener buenos resultados. Adachi (8)
reportó resultados similares en pacientes con aortitis de Takayasu
y regurgitación de la VA; además, propone el reemplazo de la RA como primera opción para
evitar el desprendimiento de la válvula protésica y la reintervención.
De
acuerdo con estas descripciones, el primer reemplazo quirúrgico fallido en nuestra
paciente no fue un evento inesperado, por lo que debería haber estado disponible
una opción adicional ya que la raíz aórtica no era accesible para realizar el reemplazo
de la RA. La reconstrucción de la VA usando pericardio tiene beneficios
técnicos en comparación con el reemplazo convencional, como el uso de estructuras
no rígidas (que encaja mejor en el pequeño anillo aórtico y aorta no móvil), sutura
directa de las nuevas valvas, y no necesidad de procedimiento de ampliación de
la RA para obtener un área de orificio adecuada. Además, la incidencia
acumulada de reoperación es 4,2% a los 10 años (para
pericardio autólogo) (4,5).
El uso de pericardio bovino en la
reparación valvular se ha vuelto controversial. Varios estudios no reportaron
diferencias en la durabilidad de la reparación con pericardio bovino versus
pericardio autólogo en niños y adultos jóvenes (9,10); sin embargo, otros
reportaron mayor calcificación y fallas de reparación con el tiempo (11). Ozaki
et al. (4) usaron predominantemente pericardio bovino para reoperar
con reconstrucción de la VA a trece pacientes que desarrollaron endocarditis
infecciosa como complicación de una reconstrucción valvular previa con
pericardio autólogo. No reportó falla en ninguno de estos procedimientos (4).
En nuestro caso, usamos pericardio bovino como última opción para ofrecer una
adecuada reparación con buena durabilidad media, porque, como se mencionó
previamente, el pericardio de la paciente no era apropiado.
Finalmente, la adición de corticoides
cumplió una función crucial en el tratamiento posquirúrgico de la paciente
debido a que no hubo resección aórtica, y la inflamación aórtica podía
progresar y provocar la dehiscencia de la reparación (3,7,8). Un hallazgo
interesante fue la presencia de infiltrados de células IgG4 que podrían indicar
un «genotipo más agresivo» de AR (10). Se necesitan estudios adicionales para
evaluar la eficacia de esta técnica como procedimiento primario o de reoperación en pacientes con compromiso reumatoideo de la
VA y RA.
Contribución de los
autores
RR:
redacción, fotografía, discusión, revisión final. JS: redacción, fotografía,
revisión final. CA, NA: discusión, revisión final. JR: redacción, discusión,
revisión final.
Referencias
bibliográficas
1.
Voskuyl AE. The heart
and cardiovascular manifestations in rheumatoid arthritis. Rheumatology (Oxford). 2006;45 Suppl 4:iv4-7. doi: 10.1093/ rheumatology/kel313.
2.
Koivuniemi R, Paimela L, Suomalainen R, Leirisalo-Repo M. Cardiovascular diseases
in patients with rheumatoidar thritis.
Scand J Rheumatol. 2013; 42
(2 ): 131 -5 . doi:
10.3109/03009742.2012.723747.
3.
Levine AJ, Dimitri WR, Bonser RS. Aortic regurgitation in rheumatoid arthritis necessitating aortic valve replacement. Eur J Cardiothorac Surg. 1999;15(2):213-4. doi: 10.1016/s1010-7940(98)00294-2.
4. Ozaki S, Kawase I, Yamashita H, Uchida S, Takatoh M, Kiyohara N. Midterm outcomes after aortic valve neocuspidization with glutaraldehyde-treated autologous pericardium. JThorac Cardiovasc Surg.
2018;155(6):2379-87. doi:
10.1016/j.jtcvs.2018.01.087.
5.
Ozaki S, Kawase I, Yamashita H, Nozawa Y, Takatoh M, Hagiwara S, et al.
Aortic valve reconstruction using autologous pericardium for patients aged
less than 60 years. J Thorac Cardiovasc Surg.
2014;148(3):934-8. doi: 10.1016/j.jtcvs.2014.05.041.
6.
Elbadawi A, Ahmed HMA, Mahmoud K, Mohamed AH, Barssoum K,
Perez C, et al. Transcatheter Aortic Valve Implantation Versus Surgical Aortic Valve Replacement in Patients With Rheumatoid Arthritis (from the Nationwide Inpatient Database). Am J Cardiol. 2019;124(7):1099- 105. doi: 10.1016/j.amjcard.2019.07.009.
7.
Xue Y, Pan J, Zhou Q, Wang Q, Cao H, Fan F, et al. Clinical Experience of Aortic Valve Surgery in Patients With Aortitis Disease. Heart Surg Forum. 2019;22(5):E366-71. doi: 10.1532/hsf.2599.
8.
Adachi O, Saiki Y, Akasaka J, Oda
K, Iguchi A, Tabayashi K. Surgical management of aortic regurgitation associated with takayasuarteritis and other forms of aortitis. Ann Thorac Surg. 2007;84(6):1950- 3.
doi: 10.1016/j.athoracsur.2007.07.025.
9.
Wiggins LM, Mimic B, Issitt R, Ilic S, Bonello B, Marek J, et al. The utility of aortic
valve leaflet reconstruction techniques in children and young adults. J Thorac Cardiovasc Surg.
2020;159(6):2369-78. doi: 10.1016/j.jtcvs.2019.09.176.
10.
Sheng W, Zhao G, Chao Y, Sun F, Jiao Z, Liu P, et al. Aortic Valve Replacement with Bovine Pericardium in Patients with Aortic Valve Regurgitation. Int Heart J.
2019;60(6):1344-9. doi: 10.1536/ihj.18-695.
11.
Nordmeyer S, Murin P, Schulz A, Danne F, Nordmeyer J, Kretzschmar J, et al. Results
of aortic valve repair using
decellularized bovine pericardium in congenital surgery. Eur J Cardiothorac Surg. 2018 Dec 1;54(6):986-992. doi: 10.1093/ejcts/ezy181.
12.
Chen L-F, Mo Y-Q, Ma J-D, Luo L, Zheng D, Dai L. Elevated serum IgG4 defines specific clinical phenotype of
rheumatoid
arthritis.
Mediators Inflamm. 2014;2014:635293. doi: 10.1155/2014/635293.
Filiación de los autores
1
Departamento de Cirugía Cardiovascular. Instituto
Nacional Cardiovascular-EsSalud. Lima, Perú.
2 Laboratorio
de Patología. Institu- to
Nacional Cardiovascular-EsSa- lud.
Lima, Perú.
a
Residente de cirugia cardiovascular
b
Cirujano cardiovascular.
c
Médico patólogo
Recibido
09 de marzo de 2021.
Aceptado:
22 de abril de 2021.
*Correspondencia
Coronel
Zegarra St. 417. Jesús María. Lima. Perú.
(+51)
969726833
Correo:
ivanrojas_12@hotmail.com
Conflictos de interés
Ninguno
para para los autores
Financiamiento
Autofinanciado
Citar como:
Rojas
P, Sisniegas J, Aguilar C, Aranda N, Ríos J. Reoperación utilizando reconstrucción valvular aórtica como
cirugía de salvataje en paciente con carditis reumatoide extensa. Arch Peru Cardiol
Cir Cardiovasc.
2021;2(2):130-134. doi: 10.47487/